Ischemické náhle cievne mozgové príhody (iNCMP)PatofyziológiaZákladným patofyziologickým podkladom vzniku ischemických náhlych cievnych mozgových príhod (iNCMP) je regionálny pokles perfúzie (prietoku krvi) mozgovým tkanivom. K poklesu perfúzie môže dôjsť z viacerých príčin, ktoré budú uvedené neskôr v samostatnej kapitole. Perfúzia môže byť chápaná ako množstvo krvi (obyčajne udávané v ml), ktoré pretečie definovaným objemom tkaniva (zvyčajne 100 g) za minútu. Namiesto termínu cerebrálna perfúzia je možné použiť termín mozgový prietok krvi (cerebral blood flow, CBF). Normálne hodnoty CBF uvádzame v tab. č. 1. Tab. č. 1 Normálne hodnoty CBF
Prietok krvi mozgom je závislý od niekoľkých ďalších
parametrov, ako je
cerebrálny perfúzny tlak (cerebral perfusion pressure, CPP), venózny
spätný tlak, intrakraniálny tlak a cerebrovaskulárna rezistencia (CVR).
Za normálnych okolností je venózny spätný tlak zanedbateľný, pokiaľ
nedôjde k zvýšeniu intrakraniálneho tlaku alebo obmedzeniu odtoku
venóznej krvi. CPP je tak CPP rovný strednému arteriálnemu tlaku.
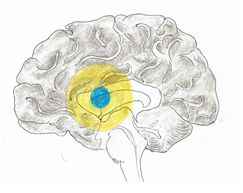
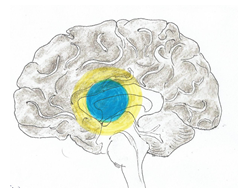
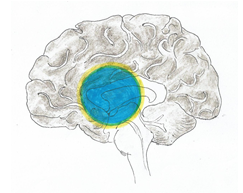
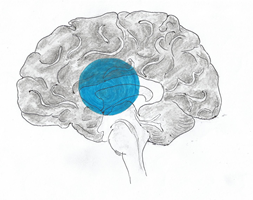
V pokoji je za fyziologických okolností prietok krvi taký, aby zabezpečil základný pokojový metabolický obrat buniek, pričom sa využije asi jedna tretina dodaného kyslíka a jedna desatina glukózy. V prípade zvýšenia funkčnej aktivity určitej oblasti mozgu, dochádza tu k vzostupu CBF a zároveň k zvýšenej spotrebe glukózy. Je zaujímavé, že spotreba kyslíka sa prakticky nemení, resp. je len mierne zvýšená. CBF je tiež závislá od zmeny parciálneho tlaku CO2 (pCO2). V prípade poklesu pCO2 na 25 mmHg napr. hyperventiláciou dochádza k poklesu CBF približne o 30 % a naopak pri vzostupe pCO2 na 50 mmHg napr. inhaláciou CO2, dochádza k 75 % vzostupu CBF. Za fyziologických okolností nie je podobná závislosť od hodnoty pO2 a až v prípade významného poklesu pCO2 napr. anémia, hypoxémia, dochádza k vzostupu CBF. Autoregulácia prietoku krvi mozgovým tkanivom je založená na dynamickej zmene jednotlivých zložiek. Zmena CPP v rozsahu 70 - 150 mmHg má len malý vplyv na CBF. Pri významnejšom poklese CPP dochádza k zmenšeniu CVR a to vazodilatáciou arteriol. V prípade regionálneho poklesu perfúzie napr. v dôsledku významného zúženia alebo uzáveru tepny na hodnoty medzi 15 - 20 ml/100 g/min dochádza k porušeniu normálnej funkcie buniek. Porucha funkcie neurónov sa najskôr prejaví porušenou elektrickou aktivitou, ktorá neskôr úplne vymizne. Z praktického pohľadu vymiznutie elektrickej aktivity neurónov znamená poruchu funkcie postihnutej oblasti a tak vznik neurologického deficitu. Tieto zmeny sú reverzibilné ak dôjde k včasnému obnoveniu mozgovej perfúzie. Oblasť mozgu, v ktorej dôjde k uvedenému typu poškodenia sa nazýva ischemický poltieň – penumbra. Základné faktory, ktoré ovplyvňujú prežitie neurónov je rýchlosť, akou vzniká pokles perfúzie a čas, ako dlho redukcia perfúzie trvá. Pokles perfúzie v intervale 5 - 10 ml/100 g/min môže byť tolerovaný menej ako1 hodinu, pokles v rozsahu 10 - 15 ml/100 g/min by mali bunky prežiť 2 - 3 hodiny. Schopnosť prežitia a tolerancia redukcie perfúzie je u jednotlivých neurónov rozdielna. Rovnako je rozdiel aj v lokalizácii ischémie - štruktúry bielej hmoty sú menej citlivé na ischémiu ako štruktúry šedej hmoty mozgu. Zásadným poznatkom je, že pokiaľ dôjde k štrukturálnemu (nie funkčnému) poškodeniu neurónov, tieto zmeny sú nezvratné a neuróny zanikajú. Takto vzniká nekrotická oblasť mozgového infarktu, ktorá je väčšinou uložená centrálne (nekrotické jadro). Ďalším z kľúčových faktorov, ktoré ovplyvňujú vznik ischémie, je funkčnosť kolaterálneho obehu. Pri dobrom kolaterálnom obehu nemusí dôjsť k vzniku mozgového infarktu ani pri významnom zúžení či dokonca uzávere tepny. Podobne to však platí aj obrátene, kedy pri nevyvinutom kolaterálnom obehu je tolerancia k ischémii podstatne nižšia. Časový vývoj mozgového infarktu, kde nedošlo k obnoveniu perfúzie je znázornený na obrázkoch č. 1, 2, 3 a 4. V prípade, že by došlo k včasnému obnoveniu perfúzie, penumbrálne tkanivo zobrazené na obrázkoch žltou farbou je potenciálne zachrániteľné, čo znamená opätovný návrat poškodenej funkcie postihnutej oblasti. Nekrotické tkanivo (modrá farba), zostáva nenávratne poškodené. Aj keď sa dlhé roky verilo, že zaniknuté neuróny nie je možné nahradiť, štúdie z posledných rokov dokazujú mozgovým infarktom indukovanú neurogenézu ako aj angiogenézu dokonca aj u pacientov vo vysokom veku. K novotvorbe neurónov dochádza v subventrikulárnej zóne, odkiaľ ešte nezrelé neuroblasty migrujú k miestu poškodenia. Ďalším známym javom, ktorý sa podieľa na obnove funkcie poškodených buniek je remodelácia axónov a plasticita mozgového tkaniva. Remodelácia axónov predstavuje regenerovanie poškodených axónov astrocytmi a oligodendrocytmi. Pod plasticitou mozgu je možné rozumieť schopnosť určitej oblasti mozgu prevziať funkciu, ktorá bola porušená v dôsledku poškodenia neurónov, v našom prípade v dôsledku ischémie.
|
|||||||||||||||||||